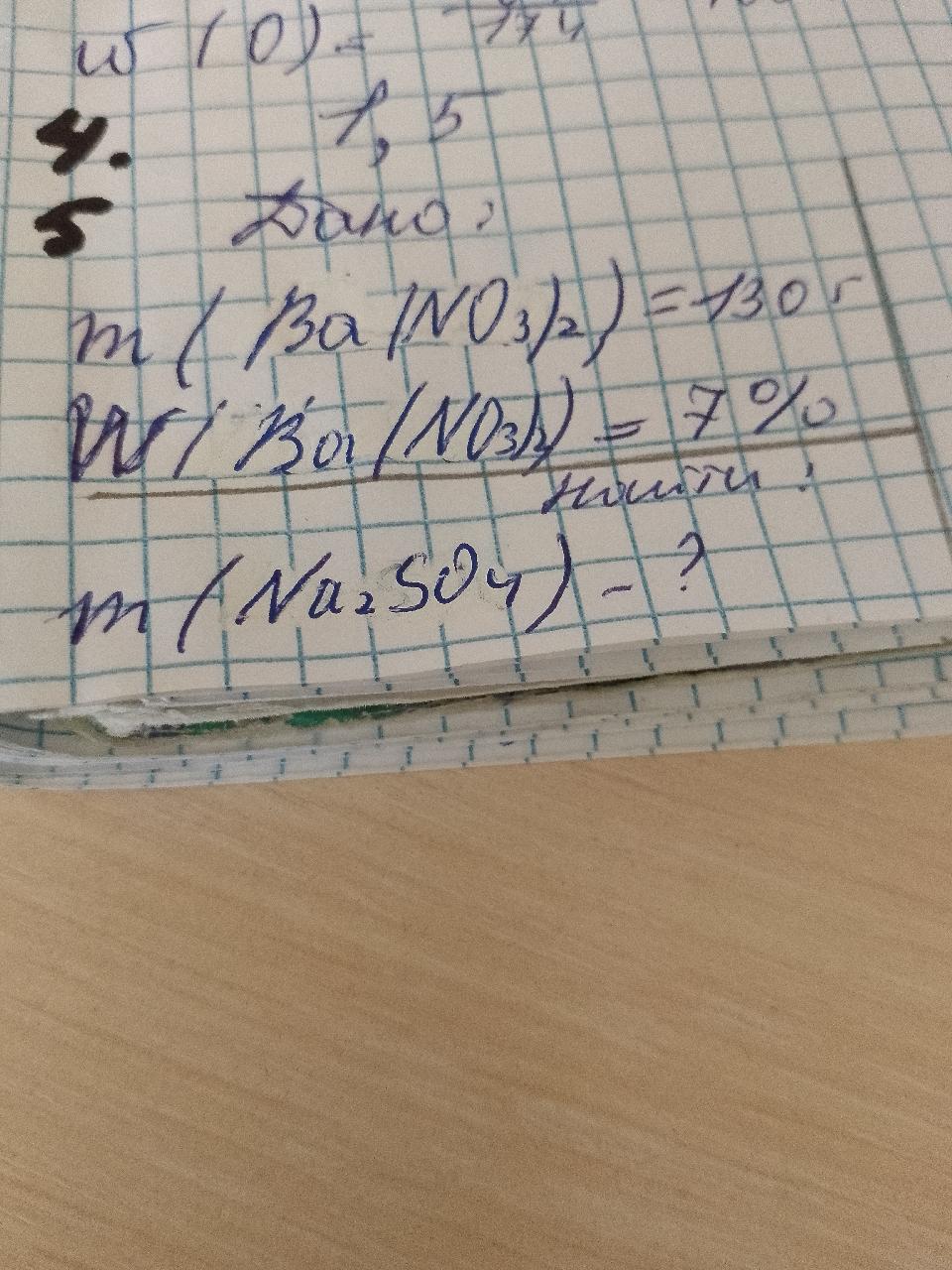Привет! Давай вместе решим эту задачу по химии.
У нас есть раствор нитрата бария с массой 130 г, в котором массовая доля нитрата бария составляет 7%. Нам нужно найти массу осадка, который образуется в результате реакции с добавлением избытка сульфата натрия.
Сначала нам нужно вычислить, сколько в этом растворе содержится самого нитрата бария. Для этого умножим общую массу раствора на массовую долю нитрата бария:
масса нитрата бария = масса раствора * массовая доля / 100%
масса нитрата бария = 130 г * 7% / 100% = 130 * 0.07 = 9.1 г
Таким образом, в растворе содержится 9.1 г нитрата бария.
Затем вспоминаем уравнение реакции между нитратом бария и сульфатом натрия:
Ba(NO3)2 + Na2SO4 → BaSO4 ↓ + 2 NaNO3
Из этого уравнения видно, что 1 моль нитрата бария вступает в реакцию с 1 молем сульфата натрия, образуя 1 моль сульфата бария. Находим молярную массу нитрата бария (Ba(NO3)2), которая равна сумме атомных масс бария (137,33 г/моль), азота (2 * 14,01 г/моль) и кислорода (6 * 16,00 г/моль):
М(Ba(NO3)2) = 137,33 + 2 * 14,01 + 6 * 16,00 = 261,34 г/моль
Теперь посчитаем количество молей нитрата бария в растворе:
количество молей = масса вещества / молярная масса
количество молей Ba(NO3)2 = 9.1 г / 261,34 г/моль ≈ 0.0348 моль
Исходя из стехиометрии реакции, аналогичное количество молей образуется сульфата бария (BaSO4). Молярная масса сульфата бария:
М(BaSO4) = 137,33 (Ba) + 32,07 (S) + 4 * 16,00 (O) = 233,39 г/моль
Теперь найдем массу сульфата бария:
масса BaSO4 = количество молей * молярная масса
масса BaSO4 = 0.0348 моль * 233,39 г/моль ≈ 8.1 г
Итак, масса образовавшегося осадка сульфата бария составляет примерно 8.1 г.
Надеюсь, моё объяснение поможет тебе лучше понять, как решать такие задачи!