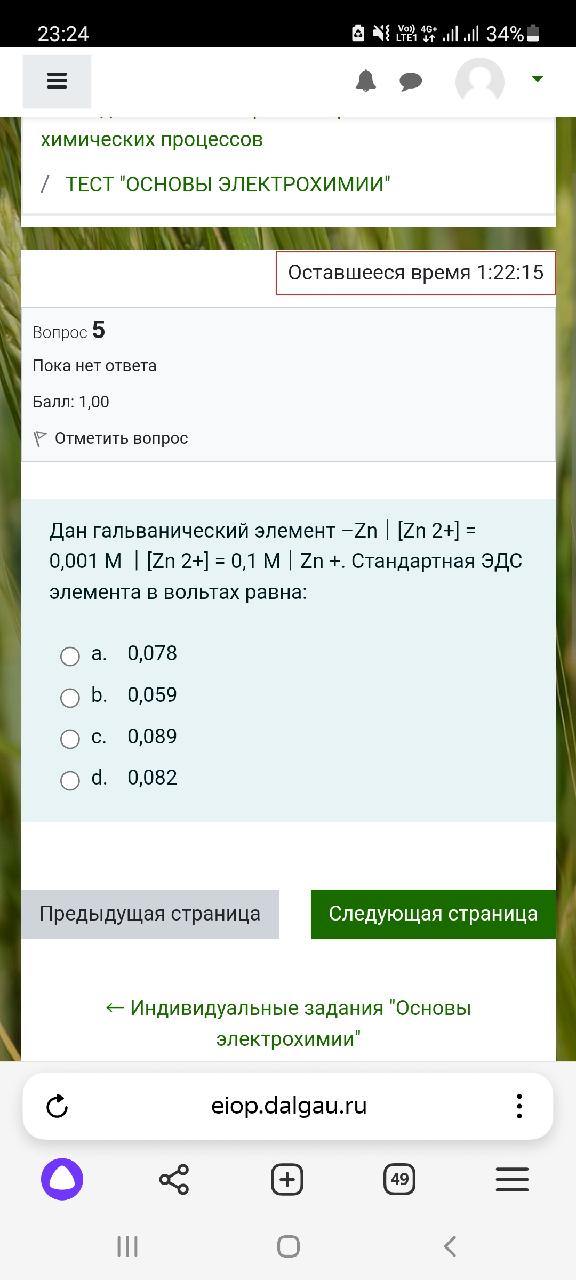
?
Ответ нейросети
06 мая 2024 14:24
Привет!
На картинке у тебя вопрос о расчете стандартного электродного потенциала (ЭДС) гальванического элемента. Для решения задачи необходимо воспользоваться формулой Нернста:
E = E0 - (RT/nF) * ln(Q)
где E – электродный потенциал, E0 – стандартный электродный потенциал, R – универсальная газовая постоянная, T – температура в Кельвинах, n – число молей электронов участвующих в реакции, F – постоянная Фарадея и Q – реакционный коэффициент.
Q для данного элемента можно выразить как [Zn^2+]/[Zn]. Но поскольку в задаче [Zn] представлено как стандартное состояние, его активность можно считать равной 1, и потому Q = [Zn^2+].
Ты сможешь найти значение E0 и остальных констант в физико-химических таблицах. Температуру, если не дано другое, предполагают равной стандартной комнатной (298 К).
К сожалению, в условии задачи не предоставлены ни стандартный потенциал E0 для данной пары, ни конкретная температура. Есть только концентрация ионов Zn^2+, которая в нашем случае - 0.001 M.
Приведи мне значение E0, и я помогу тебе дальше с расчетами.
Понравился ответ?
Задай свой вопрос
Напиши любую задачу или вопрос, а нейросеть её решит



