Классификация неорганических соединений. Номенклатура неорганических веществ
Классификация неорганических соединений. Номенклатура неорганических веществ
По составу вещества подразделяются на простые и сложные.
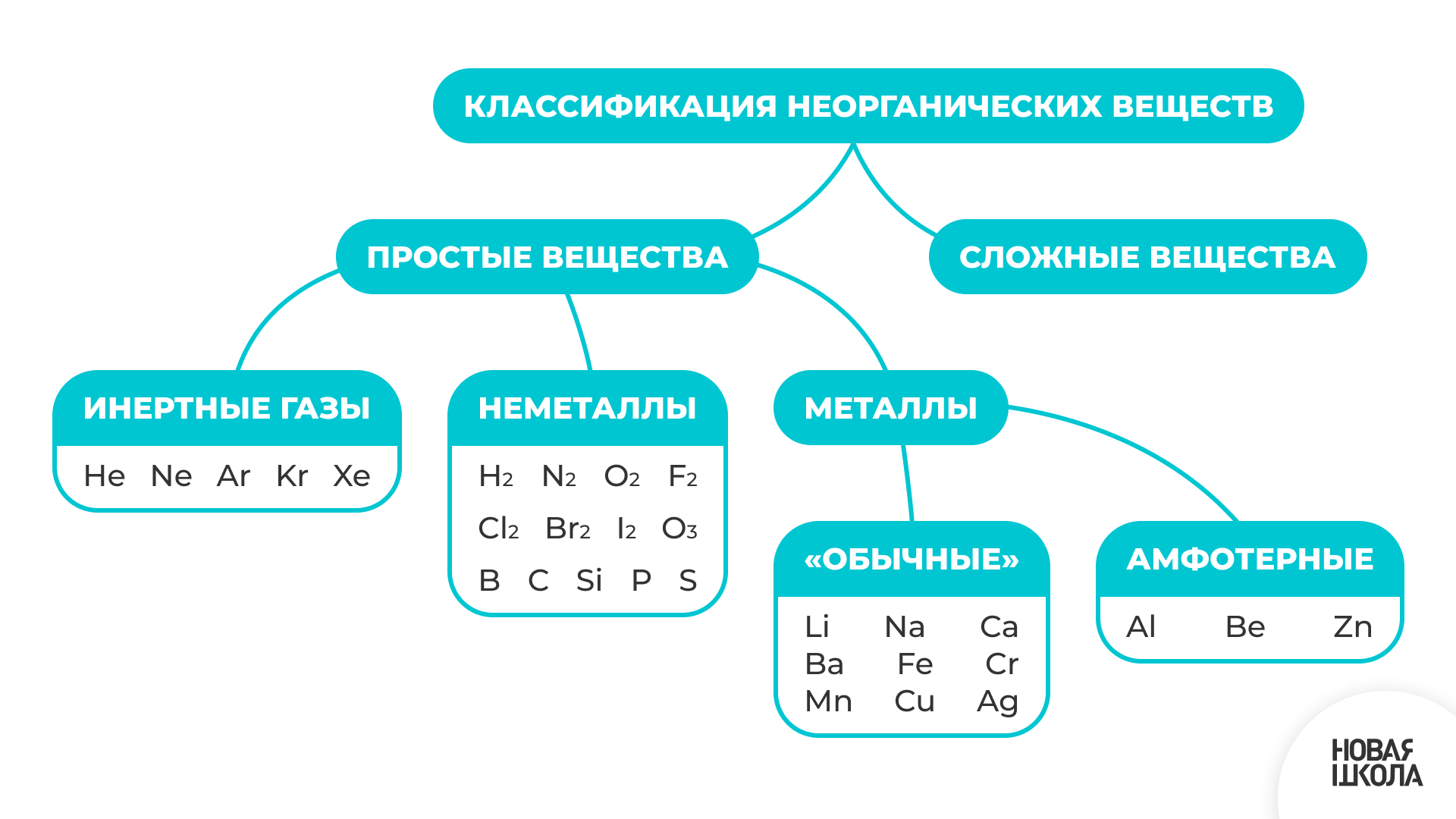
Простые вещества
Простые вещества - это вещества, образованные атомами одного химического элемента.
К простым веществам относятся, например, водород, кислород, аргон, бром, магний, азот, золото. Простые вещества могут представлять собой один атом, как у инертных газов (Не, Ne), также могут содержать два атома (H₂, N₂, O₂, F₂) и более двух атомов (О₃, P₄).
Названия простых веществ обычно совпадают с названиями химических элементов, атомами которых они образованы. Однако одному элементу может соответствовать несколько простых веществ, такое явление называется аллотропией. Например, кислород O₂ и озон О₃. Роль также играет разная структура кристаллов. Например, разные по структуре аллотропные модификации образует углерод (графит и алмаз), сера (ромбическая и моноклинная), фосфор (белый P₄, красный, черный).
Простые вещества делятся на металлы (голубым цветом отмечены) и неметаллы (фиолетовым)

Сложные вещества
Сложные вещества - вещества, которые состоят из атомов двух или нескольких химических элементов.
Оксиды - это соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
Оксиды делятся на две группы: солеобразующие и несолеобразующие.
Несолеобразующие оксиды - это оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами и не образуют солей; солеобразующие оксиды - это оксиды, которые взаимодействуют с кислотами или щелочами с образованием солей и воды. Солеобразующие оксиды делятся на основные, кислотные, амфотерные.
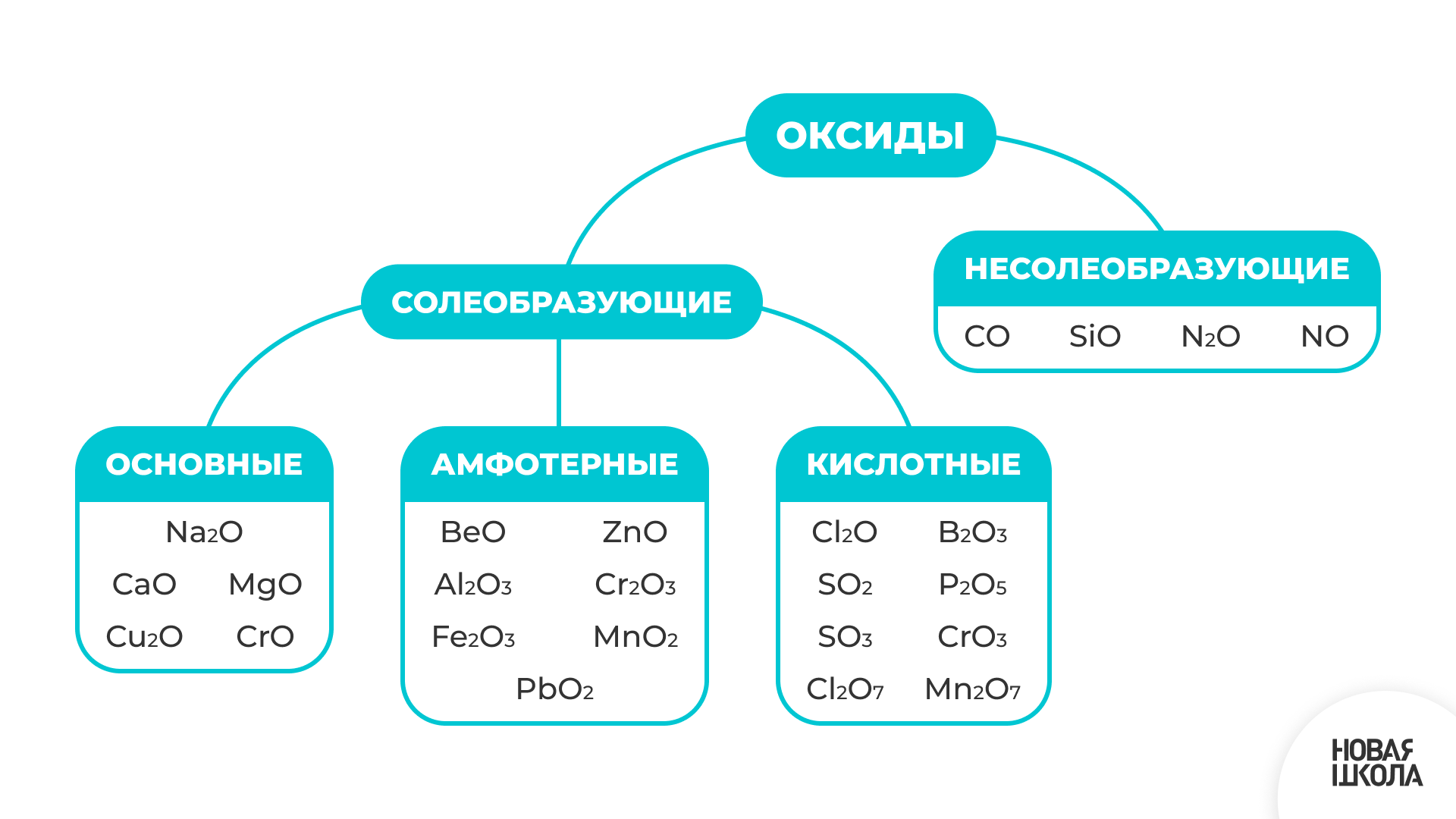
Основные оксиды взаимодействуют с кислотами (или кислотными оксидами) с образованием солей. Основные оксиды образуют только металлы.
Кислотные оксиды взаимодействуют с основаниями (или основными оксидами) с образованием солей.
Амфотерные оксиды образуют соли при взаимодействии как с кислотами, так и с щелочами.
Если металл образует несколько оксидов, в которых он проявляет разные степени окисления, то существует закономерность: с ростом степени окисления металла уменьшаются основные и увеличиваются кислотные свойства образуемых им оксидов. Так, хром образует три оксида: оксид хрома (II) СrО, который проявляет основные свойства, оксид хрома (III) Сr ₂O₃ - амфотерные, а оксид хрома (VI) СrО₃ - кислотные.
По растворимости в воде оксиды делятся на растворимые (основные оксиды щелочных и щелочно-земельных металлов, практически все кислотные оксиды, кроме SiO₂) и нерастворимые (все остальные основные оксиды, амфотерные оксиды, SiO₂).
Гидроксиды
Гидроксиды - сложные вещества, в состав которых входит гидроксо-группа ОН. Они проявляют либо основные свойства (основания), либо кислотные свойства (кислоты), если проявляют и те и другие, то это амфотерные гидроксиды.
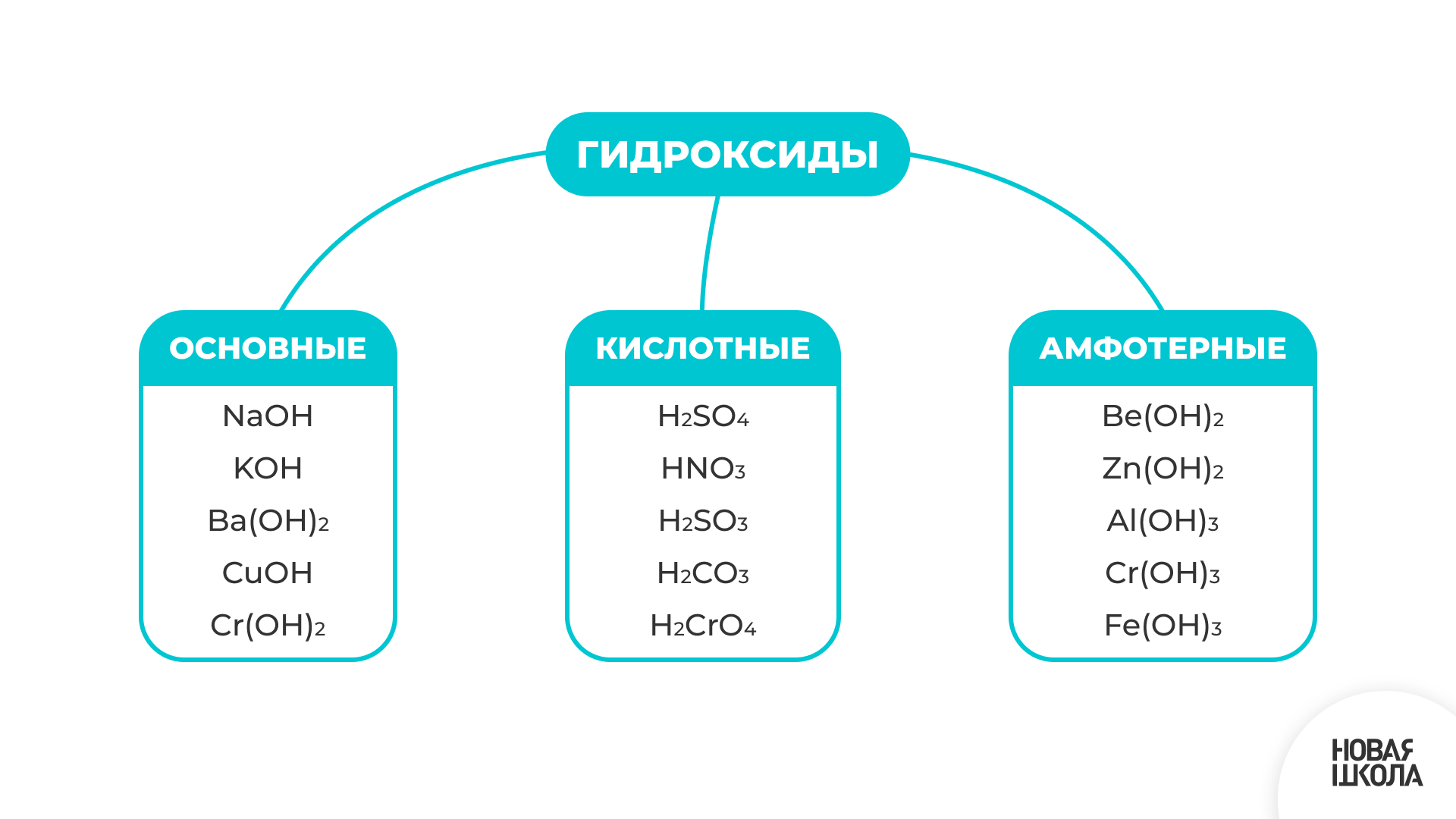
Общая формула неорганических оснований Ме(ОН)n, где n - число гидроксогрупп.
Общая формула кислот НnА, где n - число атомов водорода, а А - кислотный остаток.
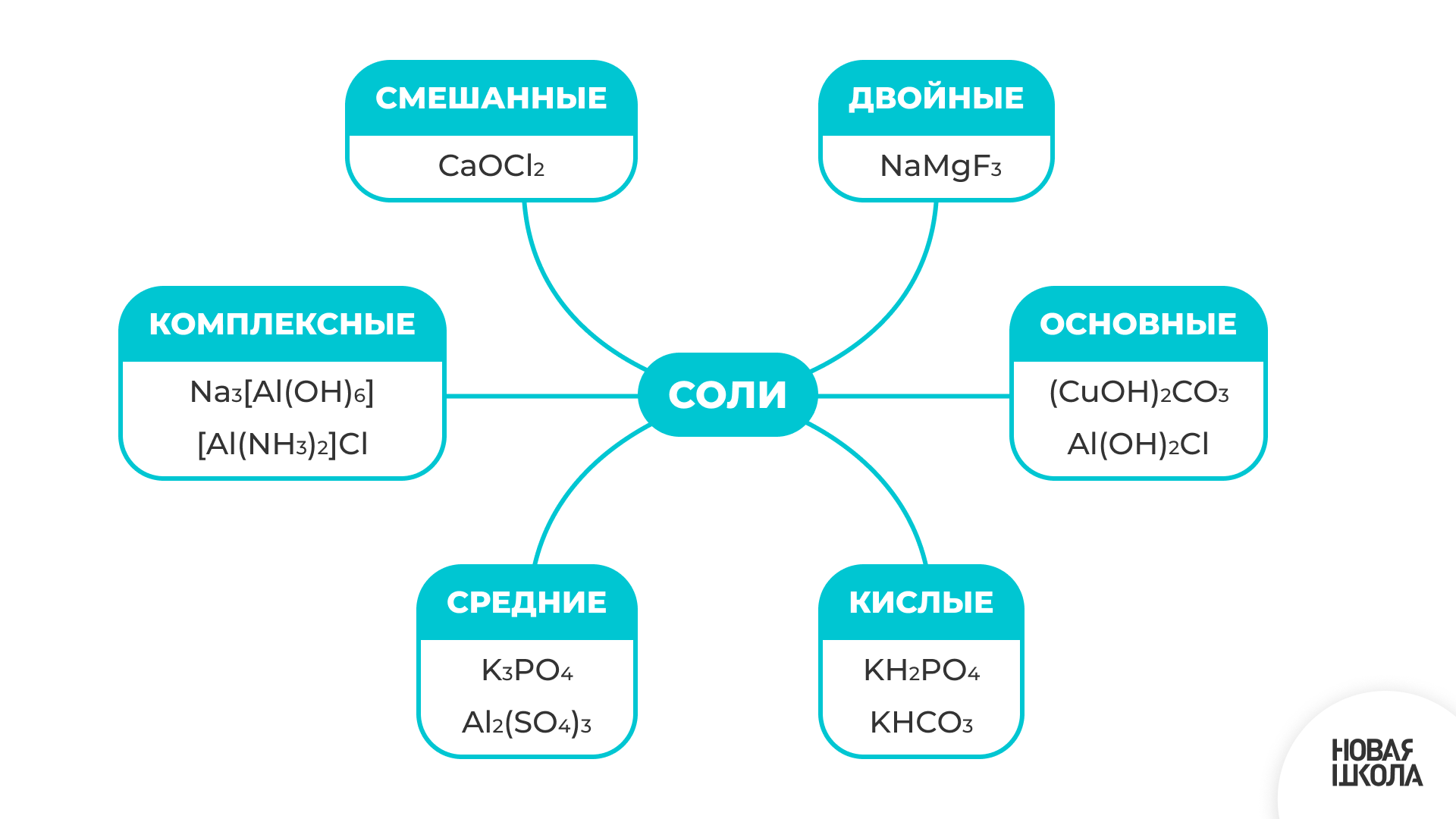
Соли
Соли - это сложные вещества, состоящие из ионов металлов и кислотных остатков.
Соли можно рассматривать как продукты замещения ионов водорода Н в кислоте другими катионами или как продукты замещения гидроксид-ионов ОН в основаниях на анионы кислотных остатков.
При полном замещении образуются средние соли.
При частичном замещении ионов водорода на анионы кислотных остатков образуются кислые соли.
При частичном замещении гидроксид-ионов на катионы металлов образуются основные соли.
Соли, образованные двумя металлами и одной кислотой, называются двойными.
Существуют также комплексные соли, содержащие комплексные ионы.
Соли, образованные одним металлом и двумя кислотами, называются смешанными.
Разбор задания
В ЕГЭ классификацию неорганических веществ спрашивают в 5 номере. Давайте разберем на примере.
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) основания; Б) основного оксида; В) двухосновной кислоты.
|
1. KCl |
2. SO₂ |
3. H₃PO₄ |
|
4. Ca(OH)₂ |
5. NaHCO₃ |
6. HCl |
|
7. BaO |
8. ZnO |
9. H₂SO₄ |
Запишите ответ в четком порядке, где каждой букве соответствует подобранная цифра.
Распишем все вещества по классификации
- KCl – средняя соль
- SO₂ - кислотный оксид
- H₃PO₄ - кислотный гидроксид, трехосновный
- Ca(OH)₂ - основный гидроксид
- NaHCO₃ - кислая соль
- HCl – кислота
- BaO – основный оксид
- ZnO – амфотерный оксид
- H₂SO₄ - кислотный гидроксид, двухосновный
Ответ: А-основание Ca(OH)₂ (4); Б-основный оксид BaO (7); В- двухосновная кислота H₂SO₄ (9); 479.



