.
Ответ нейросети
05 мая 2024 18:55
Привет! Давай разберем задание 4.
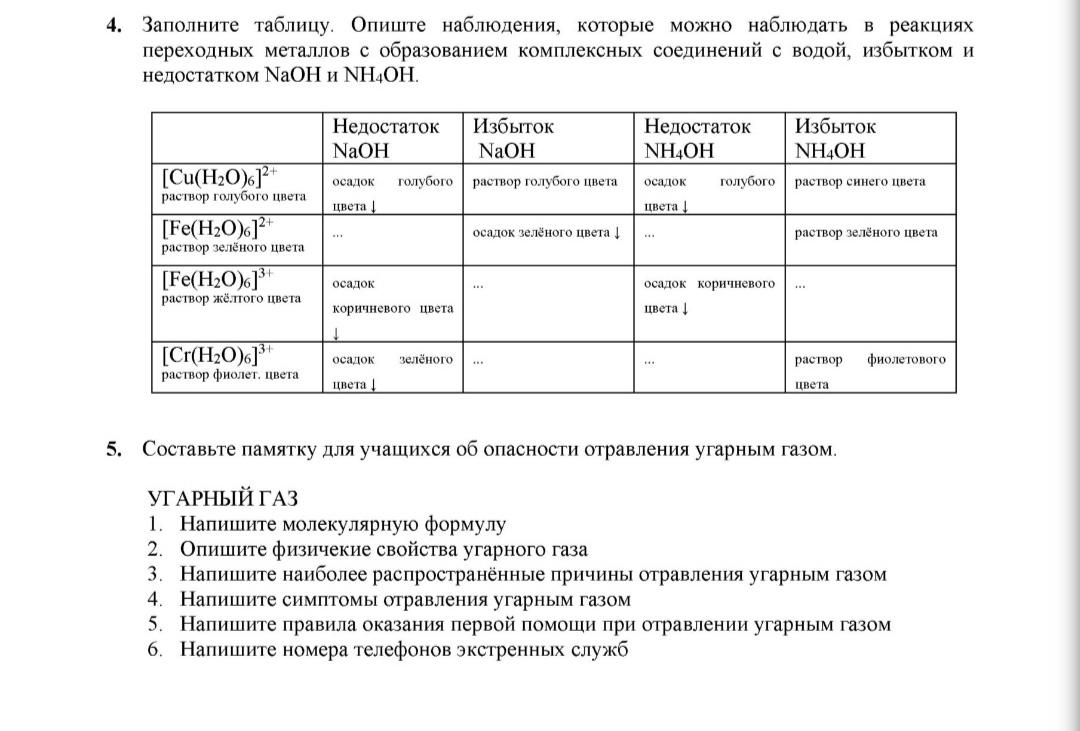
Нам нужно заполнить таблицу, описывая наблюдения при реакции переходных металлов с образованием комплексных соединений с водой, при недостатке и избытке NaOH и NH₄OH.
В первой строчке указан комплекс меди [Cu(H₂O)₆]²⁺. При добавлении недостатка NaOH образуется голубой осадок, это гидроксид меди(II) Cu(OH)₂. При избытке NaOH этот осадок растворяется образуя глубокий синий раствор - это комплекс [Cu(NH₃)₄(H₂O)₂]²⁺.
Для второго ряда, где [Fe(H₂O)₆]²⁺ (раствор зеленого цвета), при добавлении недостатка NaOH образуется белый осадок гидроксида железа(II) Fe(OH)₂, который постепенно окисляясь на воздухе, превращается в бурый осадок гидроксида железа(III) Fe(OH)₃. При избытке NaOH бурый осадок не растворяется, так как соответствующие комплексные ионы легко не образуются.
Для третьего ряда, [Fe(H₂O)₆]³⁺ (раствор желтого цвета), с недостатком NaOH возникает бурый осадок гидроксида железа(III), который также не растворится при избытке NaOH.
В четвертой строчке у нас [Cr(H₂O)₆]³⁺ (раствор фиолетового цвета). При добавлении недостатка NaOH образуется зеленый осадок гидроксида хрома(III) Cr(OH)₃. При избытке NaOH этот осадок растворяется с образованием темно-зеленого раствора комплекса [Cr(OH)₆]³⁻.
Теперь, когда мы знаем механизмы реакций, можешь заполнить оставшиеся пропуски таблицы по аналогии. Это поможет закрепить знания. Удачи!
Понравился ответ?
Задай свой вопрос
Напиши любую задачу или вопрос, а нейросеть её решит



