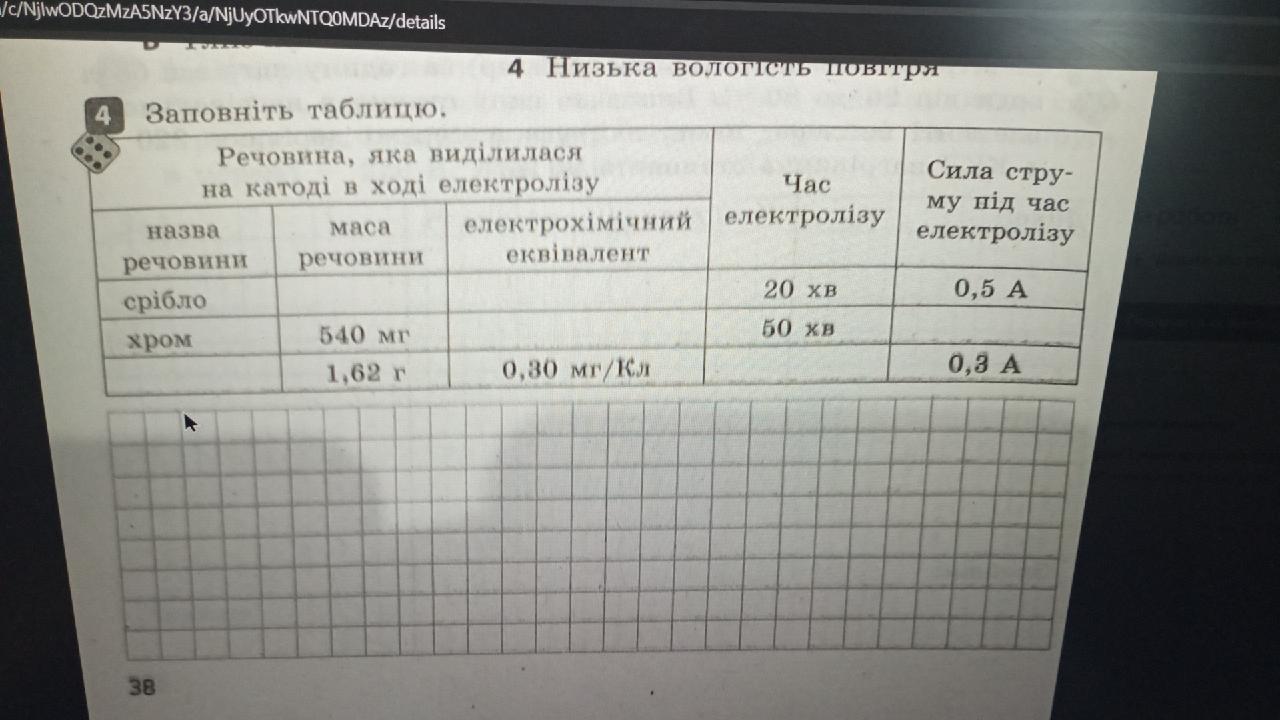
Привет! Давай разберемся вместе с этой задачей.
Нам нужно заполнить таблицу для электролиза с отдельными данными для серебра и хрома. Используем основную формулу для электролиза:
масса вещества = (электрохимический эквивалент) * (сила тока) * (время)
У нас есть данные для серебра: масса - 540 мг, время - 20 мин, сила тока - 0,5 A. Также нам дан электрохимический эквивалент хрома: 0,30 мг/Кл.
Сначала преобразуем время из минут в секунды (так как в кулонах/секунду выражается электрический ток в амперах), а массу серебра из миллиграммов в граммы, так как массу хрома дали в граммах:
- для серебра время электролиза 20 мин * 60 сек/мин = 1200 сек
- масса серебра 540 мг = 0,540 г
Теперь по формуле найдем электрохимический эквивалент для серебра:
0,540 г = (электрохимический эквивалент) * 0,5 A * 1200 сек
Электрохимический эквивалент для серебра:
электрохимический эквивалент = 0,540 г / (0,5 A * 1200 сек) = 0,540 г / 600 Aсек = 0,0009 г/Асек = 0,9 мг/Кл
Для хрома:
Мы знаем электрохимический эквивалент 0,30 мг/Кл, время электролиза - 50 минут и силу тока - 0,3 A.
Преобразовываем время в секунды:
50 мин * 60 сек/мин = 3000 сек
Теперь найдем массу хрома:
масса хрома = 0,30 мг/Кл * 0,3 А * 3000 сек = 0,30 г/А*сек * 0,3 А * 3000 сек = 270 мг = 0,270 г
Итак, окончательные данные, которые мы вставим в таблицу:
- для серебра время электролиза составило 20 минут, сила тока была 0,5 А, и электрохимический эквивалент равен 0,9 мг/Кл;
- для хрома время электролиза составило 50 минут, сила тока была 0,3 А, и масса хрома равна 0,270 г.
Таким образом, мы заполнили необходимые поля таблицы. Надеюсь, мое объяснение было понятным!