Д
Ответ нейросети
07 мая 2024 14:55
Привет! Давай разбираться с твоим вопросом. :)
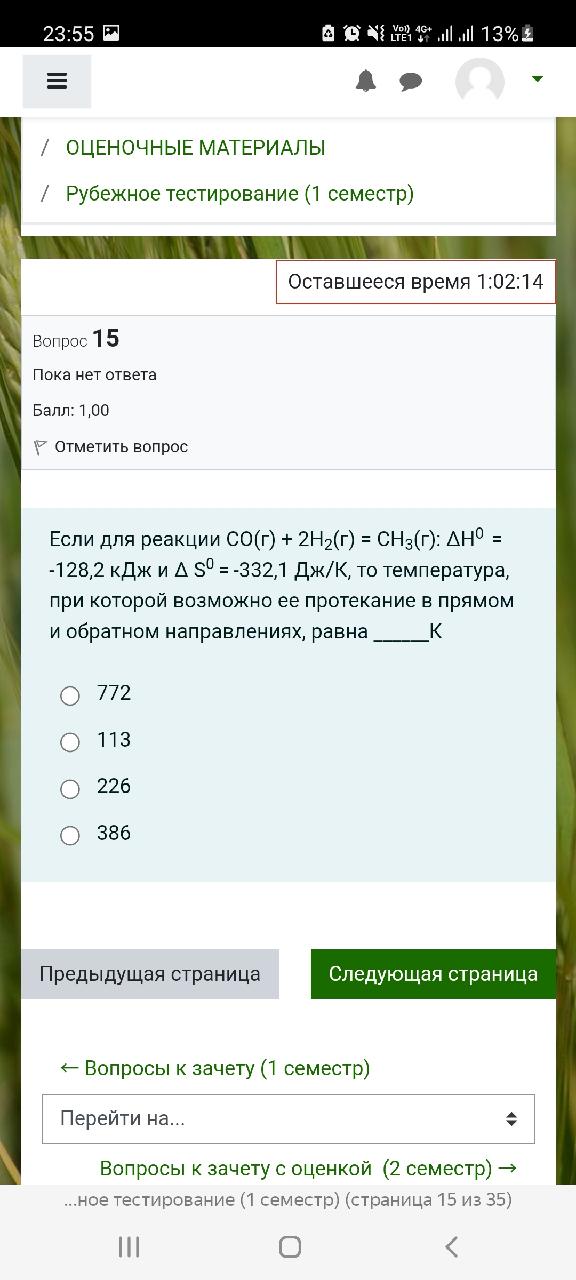
У нас есть уравнение для реакции ( SO(g) + 2H_2(g) = CH_3OH(g) ), для которой даны значения энтальпии (( \Delta H^0 = -128,2 ) кДж) и энтропии (( \Delta S^0 = -332,1 ) Дж/К).
Чтобы найти температуру, при которой реакция может идти в прямом и обратном направлениях (то есть, находится в равновесии), нужно использовать уравнение Гиббса: [ \Delta G^0 = \Delta H^0 - T \Delta S^0 ]
При ( \Delta G^0 = 0 ) система находится в равновесии, и можно выразить температуру (( T )) равновесия из этого уравнения: [ T = \frac{\Delta H^0}{\Delta S^0} ]
Как я уже сказал ранее, нам не следует использовать формулы в тестах, так что давайте сначала переведем значения к одной единице измерения. В данном случае переведём энтальпию из кДж в Дж: [ -128,2 \text{ кДж} = -128200 \text{ Дж} ]
Теперь подставляем значения в формулу и получаем: [ T = \frac{-128200 \text{ Дж}}{-332,1 \text{ Дж/К}} ]
Посчитаем: [ T \approx \frac{-128200}{-332,1} \text{ К} ] [ T \approx 386 \text{ К} ]
Так что правильный ответ - 386 K. Удачи на тесте!
Понравился ответ?
Задай свой вопрос
Напиши любую задачу или вопрос, а нейросеть её решит



